新靶向增强剂可治疗前列腺癌
原文链接: https://www.shoif.com/news/2972/
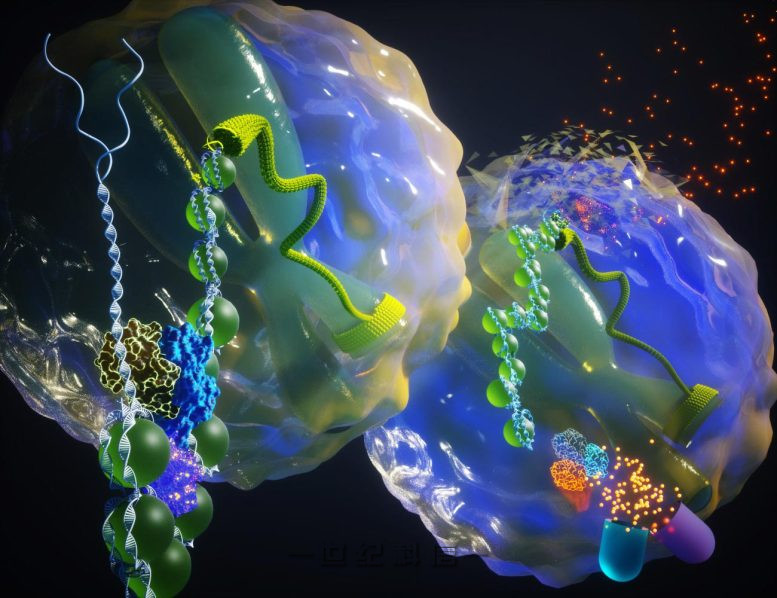
前景:SWI/SNF 允许致癌转录。背景:SWI/SNF 是致癌转录的灭活停用。来源:Ella Maru 工作室
染色质降解剂阻止转录因子驱动癌症,这可能成为超过 90% 前列腺癌的潜在治疗方法。
虽然研究人员已经确定了几个导致前列腺癌的基因,但发表在 《自然》杂志上的一项新研究 揭示了操纵琴弦的木偶大师。
推荐阅读:新的成像技术可以更好地治疗癌症和病毒感染
关键词:致癌基因或致癌基因,如雄激素受体、FOXA1、ERG 和 MYC。
一种称为 SWI/SNF 的染色质重塑复合物,它控制DNA排列和压缩以适应细胞核的方式。这种复合物的一个关键亚基提供了解开 DNA 的能量,以提供增强子元素的途径,从而提高癌症驱动基因的表达。
在目前的研究中,密歇根大学健康罗杰癌症中心的研究人员证明,SWI/SNF 复合物有助于获得癌基因可以结合并驱动癌症下游基因表达的增强子。降解这种复合物的一个亚基会阻断癌基因,就像切断木偶大师的琴弦一样。
这一发现揭示了一种治疗由不同基因驱动因素驱动的前列腺癌的新方法,这些基因驱动因素总共占所有前列腺癌的 90% 以上。
在人体细胞中,DNA 紧紧包裹在组蛋白周围,统称为染色质。这些对所有基于 DNA 的过程构成了物理屏障。已经进化出专门的蛋白质机器,它们消耗能量并调节 DNA 的物理状态以实现其功能激活。这些复合物与称为转录因子的 DNA 结合调节因子密切配合,以赋予不同的细胞特性和功能。
“这是癌症中第一次证明阻断染色质的进入可以作为治疗癌症的途径。通过压缩这些增强子元件周围的染色质,转录因子被阻止与驱动癌症的增强子元件结合,”研究作者、密歇根转化病理学和 SP Hicks 中心主任、医学博士 Arul M. Chinnaiyan 说密歇根医学院病理学和泌尿学教授。
研究人员研究了几种表达不同癌基因的前列腺癌模型。他们发现阻断 SWI/SNF 复合物可减缓癌细胞生长并诱导细胞死亡,尤其是在由 FOXA1 或雄激素受体驱动的肿瘤中。对良性前列腺细胞没有影响。
在正常发育中,SWI/SNF 复合体是必不可少的。“正常细胞可以在默认水平的基因转录下存活,但癌细胞特别沉迷于这些增强子区域。他们需要使用这些增强剂来提高致癌靶标的表达,”Chinnaiyan 说。
SWI/SNF复合物的成分在许多癌症中发生突变,但在前列腺癌中很少发生。由雄激素受体或FOXA1驱动的前列腺癌对SWI/SNF降解剂的敏感性甚至比亚基突变的癌症还要高。
“没有突变,只涉及致癌转录因子,前列腺癌细胞对这种降解剂非常敏感,甚至比通路的一个组成部分发生突变的肺癌更敏感,”Chinnaiyan 说。“通过禁用这种 SWI/SNF 复合物,我们看到了对某些癌症的优先活性,并且在正常细胞或正常组织中没有毒性。这对于使用靶向该途径的化合物进行临床研究来说是个好兆头。”
它还表明了将这种方法用于其他类型的致癌转录因子成瘾的癌症的可能性,包括一些多发性骨髓瘤和其他血癌。

钦奈扬实验室。来源:罗杰癌症中心
研究人员使用了印度公司 Aurigene Discovery Technologies 开发的 SWI/SNF 降解器。这些化合物正在开发用于未来的临床试验。
Rogel 团队将继续研究这种复合物的生物学,帮助开发针对这种复合物的化合物,并评估其他癌症类型可能对这种方法有反应。对于前列腺癌,他们正在实验室中探索使用 SWI/SNF 降解剂和抗雄激素疗法的联合疗法。这种方法尚未进入临床试验。
参考:
Lanbo Xiao、Abhijit Parolia、Yuanyuan Qiao、Pushpinder Bawa、Sanjana Eyunni、Rahul Mannan、Sandra E. Carson、Yu Chang、Xiaoju Wang、Yuping Zhang、Josh N 的“靶向增强剂成瘾性前列腺癌中的 SWI / SNF ATPases” Vo, Steven Kregel, Stephanie A. Simko, Andrew D. Delekta, Mustapha Jaber, Heng Zheng, Ingrid J. Apel, Lisa McMurry, Fengyun Su, Rui Wang, Sylvia Zelenka-Wang, Sanjita Sasmal, Leena Khare, Subhendu Mukherjee, Chandrasekhar Abbineni, Kiran Aithal, Mital S. Bhakta, Jay Ghurye, Xuhong Cao, Nora M. Navone, Alexey I. Nesvizhskii, Rohit Mehra, Ulka Vaishampayan, Marco Blanchette, Yuzhuo Wang, Susanta Samajdar, Murali Ramachandra 和 Arul M. Chinnaiyan, 22 2021 年 12 月,自然。
DOI: 10.1038 / s41586-021-04246-z
其他作者:Lanbo Xiao, Abhijit Parolia, Yuanyuan Qiao, Pushpinder Bawa, Sanjana Eyunni, Rahul Mannan, Sandra E. Carson, Yu Chang, Xiaoju Wang, Yuping Zhang, Josh N. Vo, Steven Kregel, Stephanie A. Simko, Andrew D Delekta, Mustapha Jaber, Heng Zheng, Ingrid J. Apel, Lisa McMurry, Fengyun Su, Rui Wang, Sylvia Zelenka-Wang, Sanjita Sasmal, Leena Khare, Subhendu Mukherjee, Chandrasekhar Abbineni, Kiran Aithal, Mital S. Bhakta, Jay Ghurye, Xuhong Cao, Nora M. Navone, Alexey I. Nesvizhskii, Rohit Mehra, Ulka Vaishampayan, Marco Blanchette, Yuzhuo Wang, Susanta Samajdar, Murali Ramachandra
资助:前列腺癌基金会挑战奖,国家癌症研究所授予 P50-CA186786、R35-CA231996、U01-CA214170、P30-CA046592、国防部前列腺癌研究计划 W81XWH-21-1-0500。Chinnaiyan 是霍华德休斯医学研究所研究员、A. Alfred Taubman 学者和美国癌症协会教授
披露:S. Sasmal.、LK、SM、CA、S. Samajdar、KA 和 MR 隶属于 Aurigene Discovery Technologies。JG、MSB 和 MB 隶属于 Dovetail Genomics。AMC 是联合创始人,并在 LynxDx、Oncopia 和 Esanik 的科学顾问委员会任职。AMC 是 Tempus 和 Ascentage 的科学顾问委员会成员。
相关内容
产品目录
- 宝石显微镜
- 自由曲面检测系统
- 正置荧光显微镜
- LED光源
- 光谱磨平机
- 真空冷镶嵌机
- 冷镶嵌机
- 镶嵌机
- 颗粒分析显微镜
- 油品检测显微镜
- 扫描隧道显微镜
- 光学原子力显微镜一体机
- 物证检验仪
- 切割机
- 低速切割机
- 粒径统计分析显微镜
- 工业显微镜
- 原子力显微镜
- 数码显微镜
- 显微镜热台
- 透射偏光显微镜
- 双目偏光显微镜
- 透反射偏光显微镜
- 偏光显微镜
- 荧光显微镜
- 1080P相机
- WIFI相机
- 导星相机
- USB2.0相机
- 目镜相机接口
- 尼康显微镜相机接口
- 尼康显微镜接口
- 显微镜摄像头接口
- C接口转接口
- Labomed显微镜接口
- 万向支架体视显微镜
- 显微镜相机
- CCD相机
- 薄膜微孔显微镜
- 固体粉末显微镜
- 材料分析显微镜
- 现场金相显微镜
- 金属材料分析显微镜
- 科研级金相显微镜
- 三目透反射金相显微镜
- 正置金相显微镜
- 便携金相显微镜
- 农林业显微镜
- 刑侦检测显微镜
- 体视显微镜